
Probiotici e dintorni
Categoria : scienze_varie
Data : 15 maggio 2016
Autore : admin
Intestazione :
Un'ampia disamina aggiornata delle conoscenze sui probiotici e sul loro utilizzo in base alle evidenze.
Testo :
Storia e definizioni
Circa un secolo fa, Elie Metchnikoff (uno scienziato russo, premio Nobel e professore presso l’Istituto Pasteur di Parigi) ipotizzo che i batteri lattici (LAB) potessero conferire benefici salutari in grado di favorire la longevita. Egli suggeri che “l’autointossicazione intestinale” e il conseguente invecchiamento potessero essere eliminati modificando il microbiota intestinale e sostituendo i microbi proteolitici come il Clostridium – che produce sostanze tossiche dalla digestione delle proteine, come fenoli, indoli e ammoniaca,– con microbi utili. Egli realizzo una dieta a base di latte fermentato con il batterio che lui stesso chiamo “Bacillo bulgaro”. Nel 1917 Alfred Nissle isolo una specie non patogena di Escherichia coli dal volto di un soldato della Prima Guerra Mondiale che non aveva contratto l’enterocolite durante una grave epidemia di dissenteria bacillare. Le malattie dell’intestino erano generalmente trattate con batteri vivi non patogeni per modificare o sostituire il microbiota intestinale. La specie Nissle di Escherichia coli del 1917 è uno dei pochi esempi di probiotici non LAB. Un Bifidobacterium e stato isolato per la prima volta da un neonato allattato al seno da Henry Tissier (dell’Istituto Pasteur),
e fu chiamato Bacillus bifidus communis. Tissier sosteneva che i bifidobatteri potessero sostituire i batteri proteolitici responsabili della diarrea e ne raccomandava la somministrazione ai neonati con questa patologia.
Il termine “probiotici” e stato introdotto per la prima volta nel 1965 da Lilly e Stillwell; contrariamente agli antibiotici, i probiotici erano definiti fattori derivati da microbi che stimolano la crescita di altri organismi. Nel 1989, Roy Fuller enfatizzo il requisito di vitalità dei probiotici e introdusse l’idea che essi hanno un effetto benefico sull’ospite.
Probiotici Microrganismi vivi e vitali che, se somministrati in quantità adeguata, conferiscono benefici alla salute dell’ospite
Prebiotici Sostanze non digeribili che producono un effetto fisiologico benefico sull’ospite stimolando in maniera selettiva la crescita favorevole o l’attivita di un numero limitato di batteri indigeni.
Simbiotici Prodotti che contengono sia probiotici che prebiotici.
Prebiotici e simbiotici
I prebiotici sono sostanze dietetiche (soprattutto polisaccaridi non-amidacei e oligosaccaridi mal digeriti dagli enzimi umani), che nutrono un gruppo selezionato di microrganismi che vivono nell’intestino. Favoriscono lo sviluppo dei batteri benefici rispetto a quelli nocivi. A differenza dei probiotici, la maggior parte dei prebiotici sono utilizzati come ingredienti alimentari – per esempio in biscotti, cereali, cioccolato, creme e prodotti caseari. I prebiotici comunemente conosciuti sono:
• Oligofruttosio
• Inulina
• Galacto-oligosaccaridi
• Lattulosio
• Oligosaccaridi del latte materno
Il lattulosio e un disaccaride sintetico utilizzato come medicinale nel trattamento della stipsi e dell’encefalopatia epatica.
L’oligofruttosio in natura si trova in molti alimenti, come frumento, cipolle, banane, miele, aglio e porri. L’oligofruttosio puo essere isolato dalla radice della cicoria o sintetizzato enzimaticamente a partire dal saccarosio. La fermentazione dell’oligofruttosio all’interno del colon da origine a numerosi effetti fisiologici, quali:
• Aumento del numero di bifidobatteri nel colon
• Aumento dell’assorbimento di calcio
• Aumento del peso fecale
• Riduzione del tempo di transito gastrointestinale
• Possibilità di riduzione del livello di lipidi nel sangue
Si presuppone che l’aumento di bifidobatteri nel colon conferisca benefici alla salute grazie alla produzione di composti che inibiscono i patogeni potenziali, alla riduzione dei livelli di ammoniaca nel sangue e alla produzione di vitamine ed enzimi digestivi.
I simbiotici sono combinazioni appropriate di prebiotici e probiotici. Un prodotto simbiotico produce un effetto sia prebiotico che probiotico.
Il Microbiota Intestinale
Il microbiota intestinale (termine che ha ormai sostituito la vecchia denominazione “microflora”) è un ecosistema formato da una pluralità di nicchie ecologiche, che ospitano una popolazione batterica formata da numerosissime specie e da un’innumerevole quantità di ceppi. E’ a stretto contatto con la mucosa intestinale, o interfaccia epiteliale. Sono presenti cinque phyla e precisamente i Firmicutes, i Bacteroidetes, gli Actinobacteria, i Proteobacteria e i Verrucomicrobia. In particolare due di esse sono dominanti: i Bacteroidetes (Bacteroides, Prevotella e Xylanibacter) e i Firmicutes (Ruminococcus, Clostridium, Lactobacillus, Eubacterium, Faecalibacterium e Roseburia) che rappresentano più del 90% delle categorie filogenetiche presenti nell’intestino umano, almeno nella sua parte distale. Il microbiota di ogni individuo ha una sua specifica “impronta digitale batterica”, cioè un profilo di specie suo proprio, diverso da quello di altri individui; esiste tuttavia un core di almeno 57 specie batteriche che può essere considerato comune a tutti. Due grandi progetti, basati sul sequenziamento sistematico del DNA del microbiota, sono al momento in corso: lo Human Microbiome Project (HMP), negli USA, e il Metagenomics of Human Intestine (metaHIT), in corso in Europa. Di quest‘ultimo è stato pubblicato un primo report che conferma la presenza, nel microbiota stesso, di una grande varietà di specie batteriche: oltre 1.000 nei 124 individui campionati, e circa 160 per ogni individuo studiato. Un altro progetto è il MyNewGut ( http://www.mynewgut.eu ) che metterà a profitto i risultati degli studi scientifici condotti sul microbioma umano per promuovere uno stile di vita più sano nell’opinione pubblica. Questo progetto quinquennale è stato avviato a dicembre del 2013. Il progetto MyNewGut affronterà questioni inerenti al ruolo e all’impatto del microbioma sulla salute dell’uomo in quattro aree principali:
1. Studiare approfonditamente il ruolo del microbioma intestinale, i componenti specifici nel metabolismo delle sostanze nutritive e il bilancio energetico.
2. Conoscere l’incidenza dei fattori ambientali sul microbioma intestinale in gravidanza e durante lo sviluppo del neonato, e i suoi effetti sul cervello, sul sistema immunitario e sul corretto metabolismo.
3. Identificare i componenti specifici del microbioma intestinale e i disturbi metabolici e alimentari ad esso correlati.
4. Sviluppare nuovi ingredienti alimentari e prototipi in collaborazione con l’industria alimentare europea, mirati all’ecosistema intestinale e volti a ridurre il rischio di disturbi metabolici o cerebrali.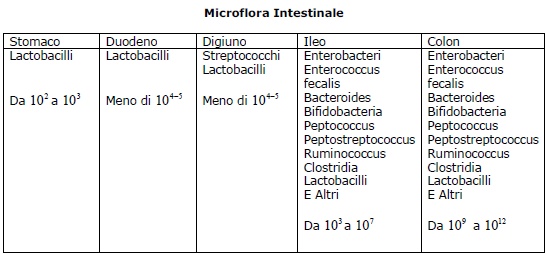
L’interazione tra microbiota ed ospite produce, per entrambi, vantaggi di varia natura. Le principali funzioni del microbiota, ad oggi note, dotate di un effetto favorevole per l’ospite sono le seguenti:
- Partecipazione alla formazione della barriera intestinale
- Resistenza alla colonizzazione: prima barriera di difesa contro l’invasione da parte di batteri patogeni.
- Produzione di acidi grassi a catena corta (SCFA): i metaboliti finali dei processi fermentativi svolgono nell’uomo funzioni fisiologiche rilevanti (l’acido acetico per i muscoli, il cuore ed il cervello; l’acido propionico per la gluconeogenesi; l’acido butirrico per la nutrizione degli enterociti.
- Produzione di vitamine: specie del gruppo B e K.
- Interazioni con il sistema immunitario di mucosa.
- Degradazione di xenobiotici: grazie a geni in grado di sintetizzare enzimi ad attività catabolica verso questi composti.
La relazione che si stabilisce tra microbiota ed ospite può essere di tipo commensale o simbiotico. I batteri del microbiota, come si ricordava, rivestono un’importanza fondamentale nel facilitare l’assorbimento degli alimenti (per esempio permettendo l’idrolisi di alcuni carboidrati non altrimenti digeribili per l’organismo) e nel prevenire la colonizzazione intestinale da parte di microrganismi patogeni, e quindi la loro penetrazione nell’organismo. E’ quindi fondamentale che il sistema immune riconosca i componenti del microbiota in quanto tali, e stabilisca una condizione di tolleranza nei loro confronti.
Modificazioni del microbiota nell’età
La flora presente nel colon evolve dalla nascita fino all’anzianità con un continuo succedersi di popolazioni batteriche caratteristiche per ogni fascia di età. Il primo contatto con i batteri avviene durante il parto. Il neonato rimasto sterile nel grembo materno, viene a contatto con i microrganismi del canale vaginale e il contatto con la madre. Anche il tipo di parto ha un forte impatto sullo sviluppo della microflora intestinale; tanto più si protrae il passaggio nel tratto vaginale, tanto più è possibile isolare batteri vivi dalla bocca e dallo stomaco del neonato. I neonati nati da parto cesareo possono essere colonizzati da batteri della madre, ma inizialmente l’esposizione maggiore è dai batteri dell’ambiente isolati dall’equipaggiamento e dall’aria. Dopo la nascita i batteri presenti nell’aria e sulla cute della madre vengono trasferiti al bambino attraverso l’allattamento e il contatto fisico. Enterobacteri e Streptococchi sono i primi a colonizzare il bambino con concentrazioni fecali di - cfu/gr raggiungendo il numero massimo dopo 3 giorni dalla nascita. Bifidobacteri e Bacteroides appaiono al quarto giorno e raggiungono il numero massimo entro il sesto giorno. Dopo pochi giorni di vita Coliformi e Streptococchi dominano la flora dell’apparato digerente.
La composizione del microbiota dei neonati allattati al seno è dominata dai Bifidobatteri acidificanti (le feci dei neonati allattati al seno sono più acide rispetto ai neonati allattati con latte formulato) e capace di esercitare un effetto barriera contro i germi patogeni.
Con lo svezzamento, l’introduzione di alimenti diversi dal latte materno, il microbiota viene ad assomigliare a quello dei bambini allattati con latte artificiale dove i Bifidobatteri, seppur numerosi, non sono dominanti. La flora fecale diviene simile a quella dell’adulto verso i due anni.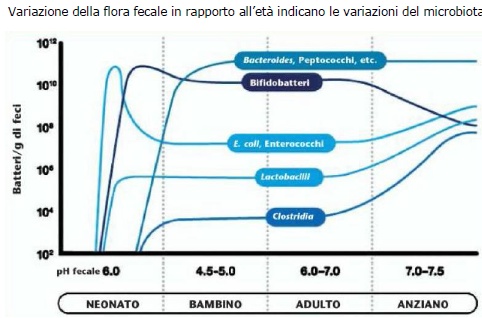
Nell’adulto il Bifidobacterium longum e il Bifidobacterium adolescentis sono i batteri predominanti e questo rafforza l’idea che la flora intestinale nei bambini allattati artificialmente assomiglia presto a quella dell’adulto. Anche i ceppi di Escherichia coli sono diversi nei due gruppi. Anche gli Enterobatteri (diversi da Escherichia coli) sono più frequenti nei bambini allattati artificialmente. Per i Bacteroides non c’è sostanziale differenza tra i due gruppi di bambini e gli adulti. Il Clostridium difficile è presente più spesso nei bambini allattati artificialmente ((49-66%) rispetto ai bambini allattati al seno (6-20%) e agli adulti (0,7%).
Negli anziani, rispetto alla popolazione giovane adulta, si manifesta inoltre una riduzione della diversità del microbiota, caratterizzata da una grande variabilità interindividuale, con numeri inferiori di Bifidobatteri e superiori in Enterobacteriaceae . Inoltre, i Bacteroidetes diventano più numerosi, mentre i Firmicutes risultano essere in numero inferiore.
Nell’anziano risultano diminuiti anche i livelli di Clostridium cluster XIVa e di Faecalibacterium Prausnitzii, i quali sono conosciuti come importanti produttori di butirrato. Nei soggetti centenari dominano i Bacteroidetes e Firmicutes (rappresentando oltre il 93% dei batteri totali).
Importanza della dieta sulla composizione del microbioma
La dieta ha un ruolo fondamentale nella composizione e la biodiversità del microbioma. In esperimenti dietetici controllati su umani si è visto che la variazione nel l’assunzione di polisaccaridi resistenti non variava la composizione di particolari batteri, Ruminococuccus bromii ed Eubacterium rectale che metabolizzano specifici carboidrati insolubili. Infatti il microbioma è in grado di metabolizzare carboidrati complessi e polisaccaridi chiamati glicani i quali portano alla produzione di acidi grassi a catena corta attraverso la fermentazione. Inoltre i batteri intestinali hanno la capacità di alterare l’utilizzazione del substrato in funzione della quantità del substrato. Per esempio l’abbondanza intestinale di Bacteroides thetaiotaomicron va incontro a cambiamenti dell’espressione genetica permettendo di metabolizzare i glicani quando questi non sono disponibili nella dieta.
Uno studio Italiano dimostrò che la composizione del microbiota differisce significativamente nei bambini che vivono in un villaggio rurale Africano del Burkina Faso rispetto ai bambini che vivono in Italia. Il microbiota dei bambini del Burkina Faso avevano una maggior quantità di Prevotella e una bassa quantità di Bacteroides e una maggior diversità e ricchezza di batteri che producevano alti livelli di acidi grassi a catena corta rispetto ai bambini Italiani. E’ ragionevole pensare che la dieta prevalentemente vegetariana dei bambini del Burkina Faso (ricca in carboidrati, fibre e proteine non animali) comparata con la dieta dei bambini Italiani (ricca in proteine animali, zuccheri, amido, grassi e bassa in fibre) ha un ruolo fondamentale in queste differenze. L’incremento degli acidi grassi a catena corta è una conseguenza della dieta vegetariana e supporta questo concetto. E’ dimostrato che la presenza di un gran numero di Prevotella nel microbiota è un marker di alimentazione vegetariana mentre un gran numero di Bacteroides è associato a una dieta tipica delle società industrializzate. Da questi studi si evince che l’incremento di frutta e verdura in una dieta ad alto contenuto di fibre e ipocalorica sono associate ad un incremento della flora intestinale. Questo comporta, anche, un miglior benessere mentre una diminuzione della flora intestinale comporta un rischio aumentato di obesità, insulino-resistenza, dislipidemia e disordini infiammatori.
Il microbiota intestinale può anche contribuire allo sviluppo dell’arterosclerosi producendo metaboliti da una dieta ricca di lipidi, come la fosfatidilcolina, che sono associati al rischio di malattie cardiovascolari. Cibi ricchi in fosfatitilcolina (soia, lenticchie, piselli, riso, uova, caviale, fegato, carne rossa) sono i maggiori fornitori di colina. Il catabolismo della colina operata dal microbiota intestinale da origine alla formazione di un gas, il trimetilamina (TMA), che è metabolizzato dal fegato in ossido di trimetilamina (TMAO) una piccola molecola che è strettamente associata al rischio di sviluppo di aterosclerosi. La conversione della colina in TMA è operata dalla colina TMA liasi. Una simile via è stata identificata per la carnitina, contenuta nella carne rossa. Questo potrebbe dare impulso alla ricerca di farmaci che inibiscono la colina TMA liasi e impedire lo sviluppo dell’aterosclerosi.
I Probiotici
Il termine probiotico (dal greco: utile alla vita) è stato coniato negli anni ’60 per definire quei “batteri vivi, benefici per l’ospite”, per i quali nel 2001 l’OMS e FAO hanno stabilito delle linee guida ben precise. Si deve quindi concludere che, in virtù delle consolidate definizioni e per una migliore informazione del consumatore, il termine probiotico sia da riservare a prodotti contenenti cellule vive e vitali. I microrganismi per essere probiotici devono rispondere ai seguenti requisiti:
• essere resistenti all’aggressione dei succhi gastrici e della bile e quindi in grado di sopravvivere anche nell’ambiente acido dello stomaco;
• aderire fermamente alla mucosa, colonizzarla e restare vitali a livello intestinale;
• essere identificati per quanto riguarda il ceppo e la concentrazione di batteri vivi;
• essere ben definiti per quanto riguarda la dose efficace e le indicazioni terapeutiche, che devono essere supportate da evidenze scientifiche.
Lo yogurt "classico", pur avendo qualità nutrizionali positive, non può essere considerato un vero probiotico, perché il Lactobacillus bulgaricus e lo Streptococcus thermophilus, i due batteri che lo caratterizzano per legge, non sono di origine intestinale. Ciò significa che non sono sempre in grado di superare indenni la barriera acida di difesa dello stomaco e dei sali biliari. Per questo motivo, i fermenti dello yogurt riescono a giungere vivi nell'intestino solo in piccole quantità e, soprattutto, non sembrano capaci di modificare la qualità dei batteri presenti in quest'organo. Una capacità probiotica che si riconosce allo yogurt, invece, è la possibilità di essere consumato anche dalle persone intolleranti al lattosio, pur contenendo ancora quantità discrete di questo zucchero.
Meccanismi di interazione tra probiotici e cellule epiteliali intestinali
- Induzione della sintesi di heat shock proteins citoprotettive.
Le cellule epiteliali intestinali (CEI), quando vengono a contatto con stress termici, osmotici, ossidativi o di altro tipo, mettono in azione un sistema di “tolleranza allo stress” basato sull’induzione delle cosiddette heat shock proteins (hsp) cellulari. Nell’intestino le heat shock proteins indotte includono la proteina hsp25, che stabilizza l’actina, e la proteina hsp72, che previene la denaturazione cellulare. Tali meccanismi contribuiscono a mantenere efficienti le tight junctions fra le CEI, promuovendo così la funzione della barriera mucosa. Nell’intestino i probiotici inducono la produzione di heat shock proteins citoprotettive.
- Modulazione dei sistemi di segnalazione infiammatori nelle CEI.
Le CEI sono munite di sistemi di segnalazione chiave per l’attivazione della risposta immune in risposta ad una varietà di stimoli. Il principale di questi sistemi è NFκB, presente nel citoplasma nella sua forma inattiva, legato alle molecole inibitorie della famiglia IκB. In presenza di stimoli pro-infiammatori, IκB viene fosforilata, si stacca da NFκB e permette così all’NFκB stesso di migrare dal citoplasma al nucleo, attivando la trascrizione di geni specifici. Alcuni probiotici modulano la degradazione di IκBα, mentre altri stimolano NFκB ad incrementare la secrezione di specifiche citochine. Lactobacillus plantarum inibisce l’attività di NFκB e la degradazione di IκB in vitro. Un altro bersaglio molecolare modulato da parte dei probiotici è il PPARγ, un recettore nucleare che
può regolare il livello dell’infiammazione intestinale, e che può in particolare svolgere un ruolo nell’attenuare alcune patologie intestinali infiammatorie inibendo l’attività di NFκB (PPARγ è infatti ridotto nelle CEI di pazienti con malattie infiammatorie intestinali, o IBD). Il trattamento con ceppi specifici di probiotici può aumentare l’espressione di PPARγ, e migliorare quindi l’infiammazione in pazienti con IBD.
- Regolazione dell’apoptosi
Alcuni probiotici possono regolare l’apoptosi (la cosiddetta “morte programmata”) delle CEI. Lactobacillus rhamnosus GG ATCC 53103 può attivare una proteina ad azione anti-apoptotica ed inibire una proteina ad azione pro-apoptotica in CEI stimolate con varie citochine (TNF,IL-1α- or IFNγ). Altri esperimenti indicano che LGG attiva la produzione di due proteine, p75 e p40, che promuovono la proliferazione cellulare ed attivano la proteina Akt anti-apoptotica. La capacità dei probiotici di regolare l’apoptosi può rappresentare anche un’utile strategia per il controllo delle infezioni intestinali.
- Modulazione dei sistemi di segnalazione dei Macrofagi
A livello intestinale i probiotici modulano diversi sistemi di segnalazione dei macrofagi, con effetti su l’immunità mucosale.
Con un uso mirato di specifici ceppi probiotici è possibile indurre una risposta di tipo immunostimolante sia sulla componente linfocitaria di tipo B (incremento dell’immunità umorale) e T (incremento dell’immunità cellulo-mediata), sia sulla componente fagocitaria, in particolare sulle cellule polimorfonucleate. La possibilità di stimolare risposte di questo tipo è utile in circostanze cliniche ben precise, per esempio quando si intenda realizzare un’immunoprofilassi delle infezioni delle alte vie respiratorie durante il periodo invernale, o in aggiunta alla vaccinazione anti-influenzale per aumentare la risposta anticorpale al vaccino o, più in generale, per aumentare la vigilanza immunitaria aspecifica verso patogeni di varia natura.
La produzione di IgA secretorie, come già detto, è uno dei meccanismi immunologici fondamentali nello stabilirsi della tolleranza orale, soprattutto nel periodo perinatale, ma anche di protezione da agenti patogeni. Il latte materno contiene già IgA secretorie che possono essere utili a questo scopo. Per i lattanti che vengono nutriti con latte formulato è
invece evidente come un latte supplementato con batteri probiotici possa favorire la naturale produzione di questa immunoglobulina. La supplementazione con probiotici è generalmente considerata sicura dal momento che vengono utilizzati microrganismi identici a quelli presenti nella flora vaginale e nel tratto gastrointestinale umani.
Quantità di microrganismi
Sulla base delle evidenze scientifiche disponibili, la quantità minima sufficiente per ottenere una temporanea colonizzazione dell’intestino da parte di un ceppo di fermento lattico è di almeno 10 alla nona cellule vive per ceppo e per giorno. La porzione di prodotto raccomandata per il consumo giornaliero deve, quindi, contenere una quantità pari a 10 alla nona di cellule vive per almeno uno dei ceppi presenti nel prodotto. L’uso di quantità diverse può essere consentito solo se il razionale per tale scelta è supportato da adeguati studi scientifici.
La quantità di cellule vive presenti nel prodotto deve essere riportata in etichetta per ogni ceppo e deve essere garantita, alle modalità di conservazione suggerite, fino al termine della shelf-life, con una incertezza di 0,5 log. (Linee Guida Probiotici. Ministero della Salute. Maggio 2013)
Sicurezza
Alcuni autori hanno proposto linee guida per la valutazione della sicurezza dei microrganismi probiotici che prevedono i seguenti criteri per i ceppi microbici destinati all’uso umano: avere un’origine umana; essere stati isolati dal tratto gastrointestinale di soggetti sani; possedere una storia documentata come germi non patogeni; non essere stati associati a malattie e, infine, non essere portatori di geni trasmissibili di resistenza agli antibiotici, soprattutto alla luce dei seri problemi che tale situazione potrebbe porre nel trattamento delle infezioni microbiche. Allo stato attuale, la qualificazione di uno specifico ceppo si basa sulla verifica dell’assenza di resistenze trasferibili relative ad antibiotici d’interesse clinico e veterinario, e dell’assenza di fattori di virulenza. Si vuole così evitare che a causa dell’ampia distribuzione ambientale dei microrganismi utilizzati dall’industria, questi possano aumentare il pool dei geni di resistenza agli antibiotici già presenti nelle popolazioni microbiche del tratto intestinale e, in special modo, incrementare il rischio di un loro trasferimento ai consumatori attraverso la filiera alimentare.
Prodotti: dosaggi
Le forme più comuni di probiotici sono i prodotti caseari e gli alimenti fortificati con probiotici. Tuttavia sono disponibili anche compresse, pillole e bustine che contengono batteri in forma liofilizzata. La dose necessaria di probiotici varia notevolmente a seconda del ceppo e del prodotto. Sebbene molti farmaci da banco contengano una quantità di 1-10 miliardi cfu/dose, e stato dimostrato che alcuni sono efficaci in dosi più basse, altri
invece richiedono dosi sostanzialmente più alte. Per esempio, il Bifidobacterium infantis risultava efficace nell’alleviare i sintomi di SII a 100 milioni cfu/die, mentre studi con VSL#3 hanno utilizzato bustine da 300-450 miliardi cfu, tre volte al giorno. Non e possibile stabilire un dosaggio generale necessario di probiotici; il dosaggio deve essere determinato basandosi su studi umani che hanno dimostrato effetti benefici sulla salute.
Applicazioni cliniche
Le attuali applicazioni cliniche dei probiotici e dei prebiotici sono riassunte qui di seguito.
Patologia cardiovascolare
• L’uso di probiotici per la prevenzione del rischio cardiovascolare non e ancora stato provato.
Prevenzione delle Infezioni delle Vie Urinarie in Adulti e Bambini
• L’uso di probiotici per la prevenzione delle Infezioni delle vie urinarie in Adulti e Bambini non è stato provato. Una Revisione sistematica Cochrane di 9 studi con 735 persone non ha mostrato beneficio, ma questo non può essere escluso per via dei piccoli studi metodologicamente scarsi.
Prevenzione delle Infezioni delle vie respiratorie
• Una revisione sistematica Cochrane di 13 studi con 3720 persone ha dimostrato che i probiotici riducono il numero degli episodi infettivi e la durata media rispetto al placebo. Tuttavia la qualità delle evidenze era bassa o molto bassa. Un’altra revisione sistematica del 2014 arriva alle stesse conclusioni.
Diarrea
Trattamento della diarrea acuta
• e' stato dimostrato che diversi ceppi di probiotici che includono L. reuteri ATCC 55730, L. rhamnosus GG, L. casei DN-114 001, e Saccharomyces cerevisiae (boulardii), sono utili per ridurre la severita e la durata della diarrea acuta infettiva nei bambini. La somministrazione orale dei probiotici riduce di circa 1 giorno la durata della malattia diarroica acuta nei bambini.
• Sono state pubblicate numerose metanalisi e studi clinici che mostrano risultati omogenei nelle revisioni sistematiche e che suggeriscono che i probiotici sono sicuri ed efficaci. I risultati degli studi sulla gastroenterite virale sono piu convincenti di quelli sulle infezioni batteriche o parassitarie. I meccanismi di azione sono specifiche per ogni ceppo: e stata
provata l’efficacia di alcuni ceppi di lactobacilli (per esempio Lactobacillus casei GG e Lactobacillus reuteri ATCC 55730) e del Saccarhomyces boulardii. Il tempo di somministrazione e anche importante. Nella diarrea cronica una revisione Cochrane mostrò insufficiente evidenza nei confronti dei probiotici sulla base di 4 RCT.
Prevenzione della diarrea acuta
• Nella prevenzione della diarrea nell’adulto e nel bambino, e' stato dimostrato solo che Lactobacillus GG, L. casei DN-114 001 e S. boulardii sono efficaci in alcuni casi specifici.
Diarrea associata agli antibiotici
• Una Cochrane del 2014 incluse 23 studi con 3938 bambini. I trials inclusero trattamenti con Bacillus spp., Bifidobacterium spp., Clostridium butyricum, Lactobacilli spp., Lactococcus spp., Leuconostoc cremoris, Saccharomyces spp. o Streptococcus spp., da solo o in combinazione. Undici studi usarono un singolo ceppo di probiotici, quattro due ceppi, tre studi usarono tre ceppi di probiotici, uno usò quattro ceppi e due sette ceppi e uno dieci ceppi di probiotici. La qualità delle evidenze era moderata. L’effetto mostrò un NNT di 10. Tra i vari probiotici usati il Lactobacillus rhamnosus o Saccharomyces boulardii da 5 a 40 miliardi di cellule vive die si dimostrano efficaci nel ridurre la diarrea.
Una revisione sistematica di sei trials con 3562 anziani, > di 65 anni, mostrò che il Bacillus licheniformis era efficace nella prevenzione della diarrea in pazienti anziani. Tuttavia non mostrò effetto preventivo per la diarrea associata ad antibiotici e del Clostridium difficile per lactobacillus acidophilus, Lactobacillus casei Shirota, Saccharomyces cerevisiae (boulardii), una miscela di Lactobacillus acidophilus e Bifidobacterium bifidum, e una miscela di Lactobacillus acidophilus, Bifidobacterium bifidum e B. lactis.
Una revisione sistematica del 2013 su pazienti ospedalizzati dimostrò l’efficacia dei probiotici nel ridurre il rischio di diarrea associata ad antibiotici e Clostridium difficile.
Un’altra revisione sistematica di JAMA del 2012 con 63 RCT con 11.811 pazienti mostro riduzione dell rischio di diarrea associata ad antibiotici e Clostridium difficile, ma c’era un’eterogeneità notevole negli studi esaminati.
Anche una revisione sistematica recente del 2016 dimostrò l’effetto protettivo dei probiotici nella diarrea associata a Clostridium difficile e una Cochrane del 2013.
Diarrea indotta da Cancro e radiazioni
• Una revisione sistematica del 2013 di 10 RCT affermò che ci sono insufficienti evidenze nell’uso di probiotici nel cancro. Per il trattamento della diarrea indotta da radiazioni una revisione di quattro studi dimostrò insufficienti evidenze nella prevenzione della diarrea indotta da radiazioni.
Eradicazione dell’Helicobacter pylory
• Molti ceppi di lactobacilli e bifidobatteri, incluso il Bacillus clausii, sembrano ridurre gli effetti collaterali delle terapie antibiotiche e migliorare la compliance dei pazienti. Molti ceppi risultavano essere efficaci nella riduzione degli effetti collaterali, ma non avevano alcun effetto sul tasso di eradicazione. Una metanalisi recente condotta su 14 studi randomizzati suggerisce che l’integrazione di antibiotici anti-H. pylori con alcuni probiotici puo essere efficace nell’incrementare il tasso di eradicazione e puo essere di supporto ai pazienti con mancata eradicazione. I dati attuali non sono sufficienti a supportare il concetto che i probiotici da soli, senza una terapia antibiotica concomitante, siano efficaci. In breve, la letteratura suggerisce che alcuni probiotici possono essere di supporto come terapia adiuvante agli antibiotici nella eradicazione dell’infezione da H. pylori.
Allergia
• L’evidenza maggiore si ha nella prevenzione delle dermatiti atopiche somministrando alcuni probiotici a donne in stato di gravidanza e neonati di eta superiore ai sei mesi, ma le evidenza sono scarse. Tuttavia, uno studio clinico recente non ha confermato questi risultati. Riguardo il trattamento di allergopatie, pochi studi ben progettati hanno dimostrato che specifici ceppi di probiotici possono essere efficaci nel trattamento dei pazienti con eczema atopico. Non ci sono prove sufficienti sull’efficacia dei probiotici nella prevenzione delle allergie agli alimenti. Una revisione sistematica ha dimostrato che i probiotici migliorano i sintomi e la qualità della vita nei pazienti con rinite allergica, ma gli studi esaminati erano di bassa qualità.
Encefalopatia epatica
• Prebiotici come il lattulosio sono comunemente utilizzati nella prevenzione e nel trattamento di questa complicanza della cirrosi. Una metanalisi del 2014 di 6 RCT mostrò che l’Encefalopatia epatica fu ridotta del 50% ma non la mortalità, la diminuzione dell’ammonio e la stipsi. Una Cochrane del 2011 mostrò risultati diversi a causa del forte rischio di bias.
Stipsi
• Una revisione sistematica del 2014 prese in esame 14 RCT con 1182 persone dimostrando l’utilità del Bifidobacterium lactis nel migliorare il tempo di transito intestinale delle feci, la frequenza delle evacuazioni e la consistenza delle feci.
Malattia infiammatoria intestinale
Pouchite
• Una metanalisi del 2015 mostrò evidenza dell’utilità dei probiotici (VSL#3) nel prevenire la pouchite e nel prevenire ulteriori recidive in seguito a induzione della remissione con antibiotici. Una Cochrane sempre del 2015 mostrò l’efficacia del VSL#3 rispetto al placebo nella pouchite cronica ma l’evidenza era bassa.
Colite ulcerosa
• Il ceppo probiotico E. coli Nissle 1917 e il VSL#3 si sono dimostrati efficaci nell’indurre la remissione e nel mantenerla nelle forme lievi-moderate di colite ulcerosa. Questi risultati derivano da due metanalisi del 2014 e una revisione sistematica del 2015. Una Cochrane del 2011, invece, dimostrava che c’erano evidenze insufficienti a causa dei piccoli numeri degli eventi registrati e il rischio di bias.
Morbo di Crohn
• Gli studi condotti sul morbo di Crohn sono risultati contraddittori. Una revisione sistematica Cochrane del 2008 e altre hanno dimostrato che non esiste alcuna evidenza che suggerisca che i probiotici siano benefici per il mantenimento della remissione del morbo di Crohn.
Sindrome dell’intestino irritabile
• Diverse revisioni sistematiche hanno dimostrato significanti miglioramenti terapeutici ottenuti con i probiotici rispetto ai placebo. Gli studi pubblicati dimostrano costantemente che il trattamento a base di probiotici riduce il gonfiore addominale e la flatulenza. Probiotici contenenti Bifidobacterium breve, Bifidobacterium longum o Lactobacillus acidophilus, Bifidobacterium breve, Bifidobacterium infantis, Lactobacillus casei, Lactobacillus plantarum sono i probiotici testati.
Enterocolite necrotizzante
• Studi clinici hanno dimostrato che i supplementi probiotici riducono il rischio di enterocolite necrotizzante in neonati prematuri con meno di 33 settimane di gestazione. Diverse revisioni sistematiche di studi controllati randomizzati hanno dimostrato una riduzione del rischio di morte in gruppi trattati con probiotici. In breve, esiste una forte evidenza dei benefici conferiti dall’uso di alcuni ceppi di probiotici nei neonati prematuri.
Epatopatia steatosica non alcolica
• L’utilita dei probiotici come trattamento per questa patologia non e stata sufficientemente confermata dagli studi clinici randomizzati.
Vaginite batterica
• Una revisione sistematica del 2014 e una Cochrane del 2009 affermano che non ci sono evidenze a favore o contro il trattamento delle vaginiti batteriche con probiotici.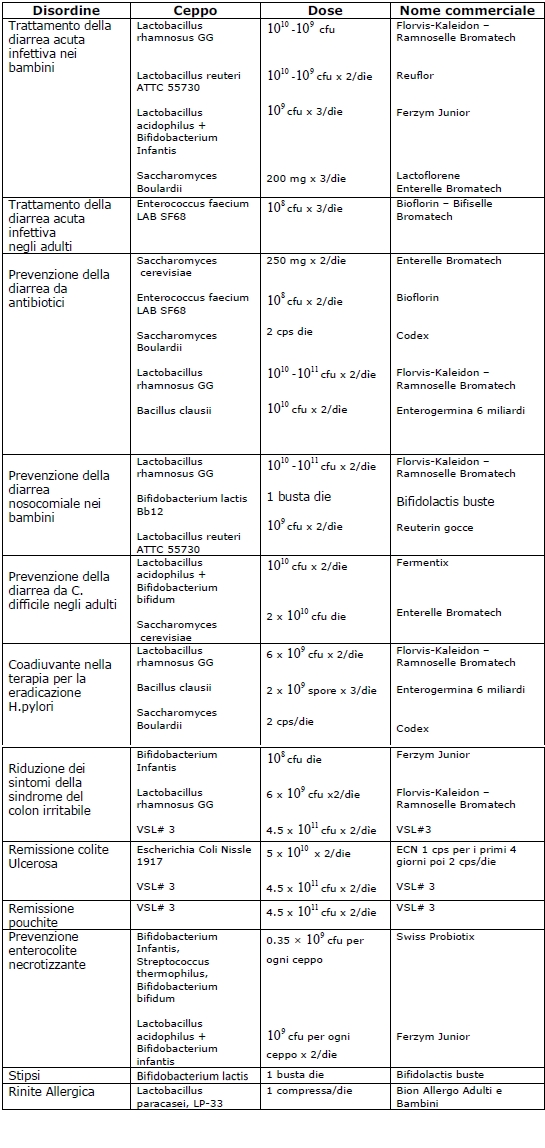
Conclusioni
Alcuni effetti dei probiotici sul funzionamento normale o patologico dell’organismo umano sono ben documentati, ed il loro impiego da soli o in associazione ad altre terapie può essere quindi considerato “evidence-based”.
In altre condizioni cliniche, invece, sono necessari ulteriori studi, perché le evidenze disponibili non sono sufficienti a dimostrare la reale efficacia dei probiotici stessi.
In generale, come più volte ricordato in questo documento, va sottolineato che gli effetti sono “ceppo specifici” e non si possono estendere ad altri probiotici dello stesso genere o specie.
Più in dettaglio, si può osservare che:
- Influenzare la composizione del microbiota, mediante la somministrazione di batteri probiotici, può contribuire in modo significativo alla salute ed al benessere dell’ospite.
- Lo studio dei possibili effetti favorevoli di miscele di ceppi deve essere specifico, e non limitarsi a “sommare” le evidenze relative agli effetti dei vari ceppi miscelati.
- Dai dati sperimentali va estrapolata anche la quantità di batteri vivi da somministrare, ed eventualmente gli effetti della matrice in cui essi vengono somministrati; tale somministrazione deve essere prolungata, in alcuni casi per tempi indefiniti.
- Nei soggetti sani, alcuni probiotici contribuiscono in modo significativo alla regolarizzazione dell’alvo, ed alla riduzione del discomfort intestinale.
- Alcuni probiotici possono antagonizzare i patogeni intestinali per antagonismo diretto (es: produzione di citochine, defensine etc) o per esclusione competitiva.
- Alcuni probiotici contribuiscono alla prevenzione della diarrea infettiva nei bambini.
- Alcuni probiotici sono associati ad un globale miglioramento dei disordini funzionali
intestinali (gonfiore, fastidio addominale etc) tipici della sindrome dell’intestino irritabile.
- Alcuni probiotici riducono la frequenza e la severità dell’enterocolite necrotizzante (NEC)
nei prematuri.
- E’ segnalata la possibilità di utilizzare i probiotici per mantenere la remissione clinica nelle
malattie infiammatorie croniche intestinali (IBD) e nella pouchite; l’evidenza sperimentale in proposito non è di elevata solidità.
- Alcuni probiotici, probabilmente grazie alla stimolazione di vie dell’immunità aspecifica, sembrano in grado di ridurre la durata e/o la gravità di patologie virali stagionali.
- Segnalazioni preliminari, anche se non del tutto univoche, suggeriscono che specifici ceppi di probiotici possano ridurre l’incidenza o alcuni aspetti dermatologici delle patologie allergiche nel bambino.
- Gli alimenti contenenti probiotici hanno dimostrato la loro sicurezza sia nella popolazione sana che in soggetti affetti da alcune patologie.
- La complessità della ricerca sugli effetti dei probiotici implica, probabilmente, l’adozione di strumenti di valutazione dei loro effetti differenti da quelli classicamente impiegati per valutare le azioni dei farmaci.
Clementino Stefanetti
Bibliografia
PROBIOTICI E SALUTE UMANA - 2013: Lo stato dell’arte basato sulle evidenze. http://goo.gl/InSH06
Albenberg LG1, Wu GD2. Diet and the intestinal microbiome: associations, functions, and implications for health and disease. Gastroenterology. 2014 May;146(6):1564-72. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4216184/pdf/nihms-580415.pdf
Zajac AE. A systematic review and meta-analysis of probiotics for the treatment of allergic rhinitis. Int Forum Allergy Rhinol. 2015 Jun;5(6):524-32.
De Filippo C. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci U S A. 2010 Aug 17;107(33):14691-6. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2930426/pdf/pnas.201005963.pdf
Wang Z. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 2011 Apr 7;472(7341):57-63.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3086762/pdf/nihms-271797.pdf
Dimidi E. The effect of probiotics on functional constipation in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr. 2014 Oct;100(4):1075-84.
Ford AC. Efficacy of prebiotics, probiotics, and synbiotics in irritable bowel syndrome and chronic idiopathic constipation: systematic review and meta-analysis. Am J Gastroenterol. 2014 Oct;109(10):1547-61; quiz 1546, 1562.
Albenberg LG. Diet and the intestinal microbiome: associations, functions, and implications for health and disease. Gastroenterology. 2014 May;146(6):1564-72.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4216184/pdf/nihms-580415.pdf
Park S. Probiotics for weight loss: a systematic review and meta-analysis. Nutr Res. 2015 Jul;35(7):566-75.
Shen J. Effect of probiotics on inducing remission and maintaining therapy in ulcerative colitis, Crohn's disease, and pouchitis: meta-analysis of randomized controlled trials. Inflamm Bowel Dis. 2014 Jan;20(1):21-35.
Mardini HE. Probiotic mix VSL#3 is effective adjunctive therapy for mild to moderately active ulcerative colitis: a meta-analysis. Inflamm Bowel Dis. 2014 Sep;20(9):1562-7.
Giuseppe Losurdo. Escherichia coli Nissle 1917 in Ulcerative Colitis Treatment: Systematic Review and Meta-analysis. J Gastrointestin Liver Dis. 2015 Dec;24(4):499-505. http://www.jgld.ro/wp/y2015/n4/a15.pdf
Naidoo K. Probiotics for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev. 2011 Dec 7;(12):CD007443.
Singh S. Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis. Cochrane Database Syst Rev. 2015 Nov 23;11:CD001176.
Fujiya M. Probiotic treatments for induction and maintenance of remission in inflammatory bowel diseases: a meta-analysis of randomized controlled trials. Clin J Gastroenterol. 2014 Feb;7(1):1-13.
Butterworth AD. Probiotics for induction of remission in Crohn's disease. Cochrane Database Syst Rev. 2008 Jul 16;(3):CD006634.
Miriam Bermudez. Probiotic Mechanisms of Action. Ann Nutr Metab 2012;61:160–174. http://goo.gl/7QfZ8z
Schwenger EM, Tejani AM, Loewen PS. Probiotics for preventing urinary tract infections in adults and children. Cochrane Database Syst Rev. 23 December 2015
Hao Q, Dong BR, Wu T. Probiotics for preventing acute upper respiratory tract infections. Cochrane Database Syst Rev. 2015 Feb 3
King S. Effectiveness of probiotics on the duration of illness in healthy children and adults who develop common acute respiratory infectious conditions: a systematic review and meta-analysis. Br J Nutr. 2014 Jul 14;112(1):41-54.
Allen SJ.Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev. 2010 Nov 10;(11):CD003048.
Bernaola Aponte G. Probiotics for treating persistent diarrhoea in children. Cochrane Database Syst Rev. 2013 Aug 20;8:CD007401.
Wilhelm SM.Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul;45(7-8):960-6.
Dang Y. The effect of probiotics supplementation on Helicobacter pylori eradication rates and side effects during eradication therapy: a meta-analysis. PLoS One. 2014 Nov 3;9(11):e111030.
Li S. Meta-analysis of randomized controlled trials on the efficacy of probiotics in Helicobacter pylori eradication therapy in children. Eur J Pediatr. 2014 Feb;173(2):153-61.
Zheng X. Lactobacillus-containing probiotic supplementation increases Helicobacter pylori eradication rate: evidence from a meta-analysis. Rev Esp Enferm Dig. 2013 Sep;105(8):445-53.
Cuello-Garcia CA. Probiotics for the prevention of allergy: A systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol. 2015 Oct;136(4):952-61.
Cao L. Long-term effect of early-life supplementation with probiotics on preventing atopic dermatitis: A meta-analysis. J Dermatolog Treat. 2015;26(6):537-40.
Kong XY. Probiotics' preventive effect on pediatric food allergy: a meta-analysis of randomized controlled trials. Chin Med Sci J. 2014 Sep;29(3):144-7.
McGee RG. Probiotics for patients with hepatic encephalopathy. Cochrane Database Syst Rev. 2011 Nov 9;(11):CD008716.
Xu J. Effects of probiotic therapy on hepatic encephalopathy in patients with liver cirrhosis: an updated meta-analysis of six randomized controlled trials. Hepatobiliary Pancreat Dis Int. 2014 Aug;13(4):354-60. http://goo.gl/UIabhg
McGee RG. Probiotics for patients with hepatic encephalopathy. Cochrane Database Syst Rev. 2011 Nov 9;(11).
Szajewska H. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Children. J Pediatr Gastroenterol Nutr. 2016 Mar;62(3):495-506.
Goldenberg JZ. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database Syst Rev. 2015 Dec 22;12:CD004827.
Xie C. Probiotics for the prevention of antibiotic-associated diarrhoea in older patients: a systematic review. Travel Med Infect Dis. 2015 Mar-Apr;13(2):128-34.
Hempel S. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012 May 9;307(18):1959-69.
Goldenberg JZ. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children. Cochrane Database Syst Rev. 2013 May 31;5:CD006095.
M. G. Redman. The Efficacy and Safety of Probiotics in People with Cancer: A
Systematic Review. Annals of Oncology. March 11, 2014
http://goo.gl/JUeYQM
L Fuccio. Effects of probiotics for the prevention and treatment of radiation-induced diarrhea. J Clin Gastroenterol. 2009 Jul;43(6):506-13. http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0028756
Didari T. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World J Gastroenterol. 2015 Mar 14;21(10):3072-84.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4356930/pdf/WJG-21-3072.pdf
Hu Y. A meta-analysis of probiotics for the treatment of irritable bowel syndrome. Zhonghua Nei Ke Za Zhi. 2015 May;54(5):445-51.
Moayyedi P. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut. 2010 Mar;59(3):325-32.
Hungin AP. Systematic review: probiotics in the management of lower gastrointestinal symptoms in clinical practice -- an evidence-based international guide. Aliment Pharmacol Ther. 2013 Oct;38(8):864-86.
Wang XL. Prophylactic probiotics for preventing necrotizing enterocolitis and reducing mortality in very low birth weight infants: a Meta analysis. Zhongguo Dang Dai Er Ke Za Zhi. 2015 Aug;17(8):852-8.
Wang Q. Probiotic supplement reduces risk of necrotizing enterocolitis and mortality in preterm very low-birth-weight infants: an updated meta-analysis of 20 randomized, controlled trials. J Pediatr Surg. 2012 Jan;47(1):241-8.
Mihatsch WA. Critical systematic review of the level of evidence for routine use of probiotics for reduction of mortality and prevention of necrotizing enterocolitis and sepsis in preterm infants. Clin Nutr. 2012 Feb;31(1):6-15.